Si stanno accumulando evidenze sul fatto che gli interferenti endocrini (EDCs, Endocrine-Disrupting Chemicals) svolgano un importante ruolo nella genesi di patologie metaboliche come il diabete mellito tipo 2 e la steatosi epatica non alcolica (NAFLD), per tale motivo alcune delle sostanze ascrivibili a questa categorie sono state racchiuse nella una “nuova” sigla MDCs, Metabolism-Disrupting Chemicals. Allo stato attuale i più comune MDCs sono i seguenti:
- Dietilstilbestrolo (DES)
- Inquinanti organici persistenti (POPs, persistent organic pollutants), tra cui il 2,3,7,8 TCDD, i PCBs, il DDT e i suoi metaboliti, i PFOS, i PFOA e il TBBPA
- MDCs non persistenti come il BPA, gli ftalati (principalmente DEHP)
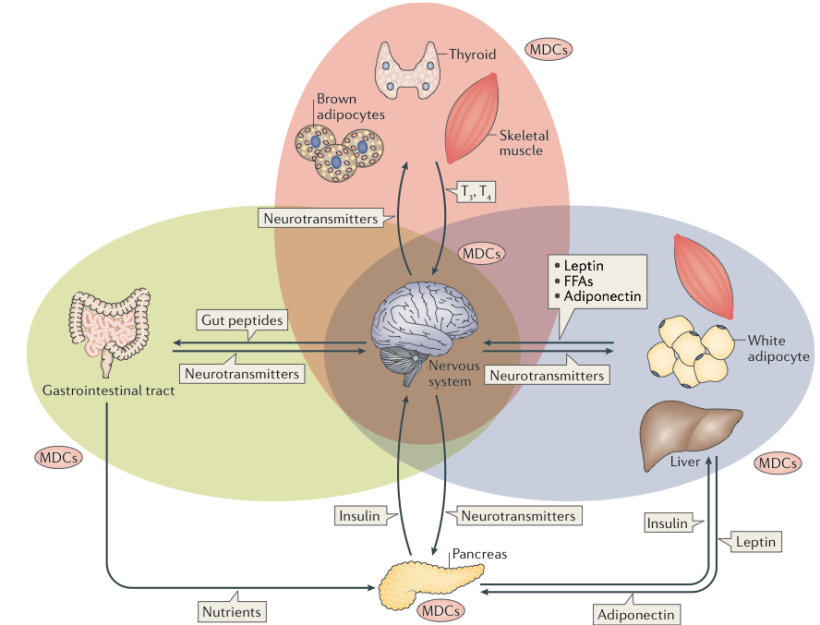
E’ noto praticamente a tutti che la regolazione dell’omeostasi energetica è di fondamentale importanza per l’organismo.
In maniera quasi banale è possibile esprimere il bilancio energetico sottoforma di una semplicissima equazione :
B.E. = Ei – Ec
Dove Ei è l’energia introdotta nel corpo, mentre Ec è l’energia consumata dal corpo.
Il mantenimento del bilancio energetico è una faccenda molto importante poiché alterazioni nel lungo periodo costituiscono sicuri fattori di rischio per numerose condizioni patologiche (diabete, NAFLD, sindrome metabolica, obesità, ecc…). Sia l’energia introdotta che quella consumata possono essere influenzate dalla esposizione a sostanze ascrivibili alla categoria degli MDCs. Di seguito si vedrà come viene alterata la quantità di energia introdotta è quella consumata.
ENERGIA INTRODOTTA
In prima analisi la quantità di energia introdotta dipende chiaramente dalla quantità di cibo ingerita, e più precisamente dall’ammontare di carboidrati, proteine e grassi. Gli MDCs sono in grado di influenzare la quantità di energia introdotta nel corpo andando ad agire a differenti livelli:
- Influenzare la quantità di energia assorbita agendo sui fenomeni di trasporto intestinale
- Interferire con la secrezione di peptidi intestinali
Ad oggi gli effetti precisi degli MDCs sul trasporto intestinale dei nutrienti e la secrezione di peptidi non sono ancora ben chiari, tuttavia si tratta di argomenti su cui la ricerca sta progressivamente facendo luce. È possibile comunque citare osservazioni ottenute da sperimentazioni animali.
Nei topi maschi adulti si è visto che l’esposizione al TCDD (100 μg/kg) aumenta l’espressione intestinale di SGLT1 e di GLUT2, producendo un incremento della glicemia in seguito a test da carico orale di glucosio.
Un plastificante, il tributil-citrato (10 μM) è in grado, anche nell’uomo, di aumentare l’assorbimento intestinale di colesterolo attraverso una upregolazione del trasportatore di questa molecola, ottenuta per mezzo del PXR (pregnane X receptor).
Per quanto concerne i peptidi intestinali oggi sappiamo che svolgono un ruolo essenziale nella regolazione del food intake e della spesa energetica.
Alcuni tra i più importanti sono sicuramente la ghrelina, il GLP-1, il peptide YY e la colecistochinina (CCK). L’esposizione cronica ad idrocarburi policiclici aromatici determina una diminuzione dei livelli intestinali di CCK in ratti femmina adulti. Inoltre l’esposizione al TCDD (50 nM) è capace di abbassare il livello degli enzimi deputati alla sintesi del CCK.
- Alterare la composizione del microbiota intestinale
Il ruolo svolto dal microbiota intestinale sul bilancio energetico è importante, e si concretizza attraverso l’influenza di numerosi aspetti, tra cui il metabolismo epatico, la permeabilità e la motilità dell’intestino, il livello di infiammazione intestinale.
Si è visto che nei topi maschi adulti, l’esposizione al 2,3,7,8 – tetraclorodibenzofurano (TCDF) in quantità di 24 μg/Kg di peso corporeo al giorno, altera il microbiota intestinale attraverso l’interazione con il recettore per gli idrocarburi arilici (AHR), che produce inibizione del recettore X per i farnesoidi (FXR) e quindi influenza il metabolismo degli acidi biliari. Inoltre il TCDF determina una alterazione nei livelli di acidi grassi a catena corta, nei processi di lipogenesi epatica, glicogenolisi e gluconeogenesi.
Sempre nei roditori alcuni studi hanno evidenziato cambiamenti nelle quantità dei metaboliti prodotti dal microbiota, secondariamente ad esposizione a miscele di PCB, arsenico, cadmio e insetticidi organofosfati, come il chlorpyrifos.
Ad ogni modo l’interazione tra MDCs e microbiota intestinale è biunivoca, in quanto i microrganismi sono capaci di metabolizzare le sostanze producendo metaboliti che hanno, sull’ospite, effetti diversi rispetto alle molecole di partenza. Si sta pertanto aprendo la prospettiva di “sfruttare” questa capacità del microbiota per diminuire l’effetto di sostanze notoriamente obesogene, diabetogene, o che in ogni caso esplicano una funzione di alterazione del normale metabolismo.
- Influenzare i livelli di neuropeptidi ipotalamici che regolano il “food intake”
L’assunzione di cibo e quindi di energia dipende fortemente dalla regolazione dell’appetito. Si ritiene che l’ipotalamo svolga un ruolo di primaria importanza nella gestione della fame e della sazietà. All’interno dell’ipotalamo esiste una regione, denominata nucleo arcuato (ARC) che è la prima a ricevere segnali dalla periferia. Nell’ARC esistono due distinte popolazioni di neuroni, una che esprime il neuropeptide YY e la Agouti Related Protein (AgRP), e un’altra che esprime POMC e CART. La prima popolazione di neuroni ha azione oressigena, mentre la seconda è anoressigena. Il nucleo arcuato comunica con altre regioni ipotalamiche, tra cui il nucleo ventromediale e il nucleo paraventricolare.
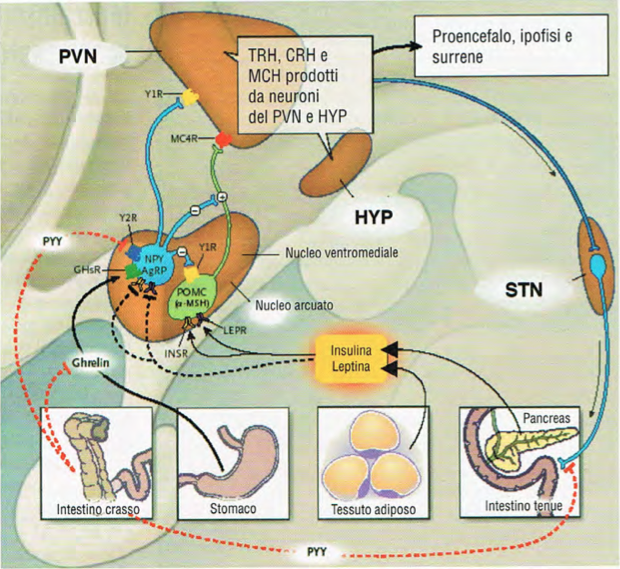
Si è visto che l’esposizione neonatale a xeno-estrogeni come il bisfenolo A (0,05-2 mg/Kg di peso corporeo al giorno) determina una minore espressione dei recettori α per gli estrogeni nei ratti femmina adulti, a livello del nucleo arcuato. il blocco dell’esposizione dei recettori α per gli estrogeni nel nucleo ventromediale induce iperfagia e porta a sindrome metabolica.
Se nel corso della gravidanza i topi sono cronicamente esposti al TBBPA (150 mg/Kg di peso corporeo al giorno), oppure se l’esposizione si realizza in maniera acuta sui topi appena nati (2,1 gr/Kg di peso in una singola iniezione), si osserva una inibizione della attività trascrizionale del TRH (TSH-releasing hormone) e del recettoro 4 delle melanocortine (MC4R), nellipotalamo. L’MC4R è il maggior regolatore dell’omeostasi energetica, e mutazioni di questo recettore portano ad obesità.
Oltre ai topi, anche in altri modelli animali si sono osservate alterazioni nell’espressione di peptidi ipotalamici che regolano l’assunzione di cibo, in seguito ad esposizione, si in periodo perinatale che adulto, a sostanza come TBT, PCBs, triclosan, TCDD, PFOS.
SPESA ENERGETICA
Il consumo energetico totale del corpo è composto dalla sommatoria dell’energia consumata da ciascuno dei seguenti processi:
- METABOLISMO BASALE
- TERMOGENESI
- ATTIVITA’ FISICA
1. (Metabolismo Basale) – Esistono evidenze a supporto dell’idea che gli MDCs siano in grado di influenzare il metabolismo basale. Nell’ambito di quest’ultimo il ruolo svolto dai mitocondri è predominante, e la loro attività può essere modulata andando ad agire sulla catena di trasporto degli elettroni. Osservazioni in vivo hanno permesso di chiarire come l’esposizione al BPA (50 μg/Kg di peso corporeo al giorno) dallo svezzamento a 24 settimane, producano una minore attività della catena di trasporto degli elettroni, e dunque una minore produzione di ATP. La diminuzione della produzione di ATP è confermata anche da osservazioni in vitro su cellule di neuroblastoma, dove una mistura di PCB altera il potenziale di membrana dei mitocondri, diminuisce la velocità della fosforilazione ossidativa e della glicolisi.
2. (Termogenesi) – Come lascia intendere la parola stessa il processo di termogenesi è un fenomeno che conduce alla liberazione di calore, e nel corpo viene messo in atto, in funzione alle necessità (ad esempio l’esposizione al freddo), principalmente dal tessuto muscolare e dal tessuto adiposo bruno. Quest’ultimo in particolare ha la capacità di generare calore attraverso il disaccoppiamento della fosforilazione ossidativa e la produzione di ATP, mediante una particolare proteina denominata UCP1.
Si è visto che l’esposizione perinatale al DDT (1,7 mg/Kg di peso corporeo al giorno) di topi femmine produce effetti a lungo termine sulla termogenesi. Infatti questi topi all’età di 6 mesi evidenziano una diminuzione della termogenesi, principalmente poichè a livello del tessuto adiposo bruno, diminuisce l’espressione di PPARGC1α (un regolatore fondamentale dei geni coinvolti nel processo di termogenesi) e di Dio2 (codifica per la iodiotironina deiodinasi tipo 2, un enzima che catalizza l’attivazione dell’ormone tiroideo T4 a T3).
Ad ogni modo non tutti gli MDCs hanno il medesimo effetto sulla termogenesi, infatti il PFOA e i PFOS agiscono in maniera quasi inversa al DDT. Topi esposti a PFOA e PFOS per 10 giorni in età adulta, esibiscono un livello più alto di termogenesi, dovuto ad una maggiore attività dei mitocondri nel tessuto adiposo bruno, così come un maggior livello di UCP1 unitamente a capacità ossidative migliorate. Queste osservazioni sono confermate anche da esperimenti in vitro, dove si è visto che dosi tra 80-480 μM di PFOA agiscono direttamente su UCP1.
Gli studi epidemiologici sull’uomo hanno osservato una relazione tra i livelli di PFOA e PFOS nel cordone ombelicale e il basso peso alla nascita, tuttavia quali siano gli effetti a lungo termine dell’esposizione perinatale a tali sostanze, rimane ancora da indagare.
3. (Attività Fisica) – Gli effetti degli interferenti endocrini sulla spesa energetica conseguente alla attività fisica, non sono ben chiari, anzi spesso i risultati degli esperimenti conducono ad osservazioni contrastanti, sia su sostanze diverse, sia sulla stessa sostanza, “somministrata” però in periodi diversi della vita. Inoltre quasi tutti gli studi non si focalizzano sulla spesa energetica dell’attività motoria, quanto piuttosto sugli effetti comportamentali degli interferenti endocrini, e quindi come essi alterino il livello totale di attività fisica.
DEPOSITI ENERGETICI
Quando il bilancio energetico è positivo, cioè quando l’energia introdotta è più elevata di quella spesa, si creano le condizioni per l’ “accumulo di energia”. Il nostro organismo sostanzialmente accumula energia sottoforma di glicogeno e di trigliceridi. Di seguito si vedrà come gli MDCs possono agire sui tessuti deputati all’accumulo energetico.
MUSCOLO SCHELETRICO
Il muscolo scheletrico è il tessuto che più di tutti assorbe glucosio sotto stimolazione insulinica, attraverso l’esposizione in membrana dei trasportatori GLUT4.
Entro certi limiti il muscolo scheletrico può accumulare glicogeno e trigliceridi, da ossidare poi al momento del bisogno, ovvero durante l’attività fisica e la termogenesi.
Topi alimentati con una dieta ad elevato contenuto di grassi, in presenza di PCBs e pesticidi, mostrano una significativa riduzione dell’uptake di glucosio stimolato dall’insulina. Coerentemente a questo risultato, ratti trattati con 2 mg/Kg di peso al giorno di Aroclor 1254 (una mistura di differenti PCBs), per un periodo di 30 giorni, evidenziano una diminuzione di GLUT4 nel muscolo scheletrico.
Gli effetti del BPA sono invece mediati da una minore fosforilazione di Akt in risposta all’insulina, producendo pertanto insulino-resistenza.
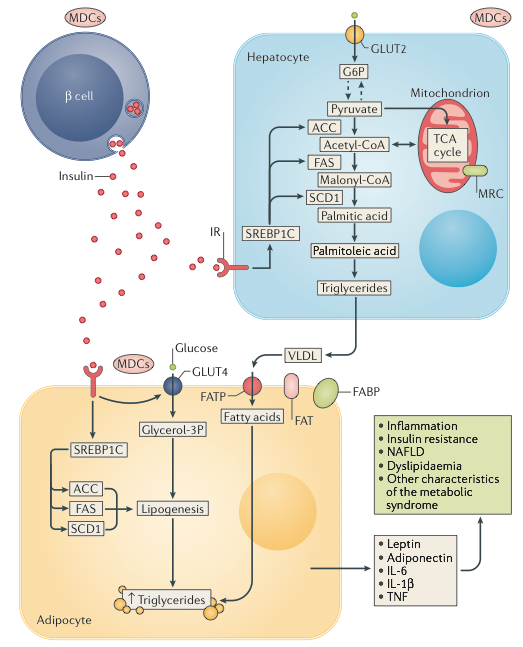
FEGATO
Per quanto concerne i depositi energetici l’azione dell’insulina sul fegato induce sostanzialmente due cose: stimola la sintesi di glicogeno e la sintesi di trigliceridi. Infatti l’insulina agisce, attraverso Akt, sull’attivazione della glicogeno fosforilasi. Sempre mediante il pathway di Akt l’insulina aumenta l’espressione del gene che codifica per SREBP1C (sterol regulatory element-binding protein 1 isoform C), che è un regolatore trascrizionale fondamentale per i geni che codificano alcuni dei principali enzimi lipogenici: ACC, acetil-CoA carbossilasi; FAS, acido grasso sintasi; SCD1, stearoil-CoA desaturasi 1.
Gli MDCs sono capaci di alterare i complessi pathways metabolici epatici connessi con l’insulina, sia che l’esposizione avvenga in età adulta, che nel periodo perinatale. Gli effetti sono dovuti ad una azione diretta di queste molecole sugli epatociti, o ad un alterazione del rilascio di insulina da parte delle cellule beta del pancreas.
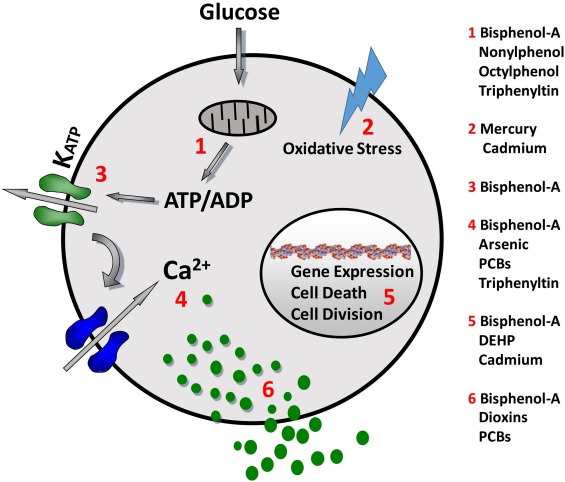
Attraverso l’interazione con il recettore per gli idrocarburi arilici (AHR) le diossine esplicano la loro azione “lesiva” sul metabolismo energetico. L’esposizione a basse dosi di diossina (e composti simili) produce una diminuzione del rilascio di insulina e del trasporto di glucosio, nelle cellule beta pancreatiche di topo, e in generale produce un “quadro” di espressione genica (riduzione dei livelli di mRNA per i geni codificanti SREBP1C, FAS, ACC, e GCK (glucochinasi)) tipica dell’insulino-resistenza epatica. Con dosi elevate di diossina o composti simili, diminuisce sia la gluconeogenesi (downregolazione dei geni slc2a2 (codifica per GLUT2), G6pc (codifica per glucosio 6 fosfatasi), pck1 (codifica per fosfoenolpiruvato carbossichinasi)) che la lipogenesi (downregolazione dell’espressione dei geni che codificano per ACC e FAS). E’ fondamentale osservare come tutti questi effetti siano completamente assenti nei topi sprovvisti del recettore per gli idrocarburi arilici. Come osservato in studi epidemiologici sull’uomo, il bilancio energetico negativo prodotto dalle diossine, contribuisce ad incrementare il livello circolante di lipidi, costituendo un importante fattore di rischio per il diabete mellito di tipo 2.
In generale l’esposizione al bisfenolo A produce pesanti alterazioni dell’omeostasi glucidica. Si è visto che dosi importanti (10-100 μg/Kg di peso corporeo al giorno) di BPA nell’ambiente, interagendo con i recettori extranucleari per gli estrogeni, inducono un aumento del rilascio di insulina indotto dal glucosio, nonchè un aumento dell’insulinemia non a digiuno negli esemplari adulti di topo. Mediante l’aumento dell’espressione dei geni coinvolti nella lipogenesi, come Pparg, Nr1h3, Esr1, Srebf1 e Srebf2, il BPA induce insulino-resistenza epatica; inoltre aumentando l’espressione di GLUT2, viene favorito l’ingresso di glucosio negli epatociti. Anche quando l’esposizione al BPA avviene in gravidanza o nel periodo perinatale, si evidenziano sostanziali alterazioni del metabolismo energetico. Il fenomeno di maggior rilievo è l’accumulo di trigliceridi in sede epatica, che si accompagna a disfunzione mitocondriale. E’ evidente quindi che l’accumulo di lipidi, la diminuzione delle capacità ossidative mitocondriali, con l’aumento contemporaneo della lipogenesi, contribuiscono a determinare condizioni di iperinsulinemia, insulino-resistenza, ed elevati livelli di acidi grassi non esterificati circolanti, che si osservano in animali esposti al BPA.
TESSUTO ADIPOSO BIANCO
Il tessuto adiposo bianco subisce gli effetti degli MDCs e talvolta li accumula (se le molecole sono lipofile) al suo interno. Ad ogni modo le alterazioni di maggior rilievo indotte dagli MDCs riguardano l’adipogenesi e l’alterazione della “funzione endocrina” del tessuto adiposo bianco.
L’eposizione nei primi momenti di vita a sostanze come il TBT, gli ftalati, il BPA, il DDT, il TBBPA, il DEHP, favoriscono la differenziazione dei preadipociti in adipociti. Ciò non significa che queste sostanze automaticamente rendono obesi, ma senza dubbio creano un ambiente fortemente predisponente.
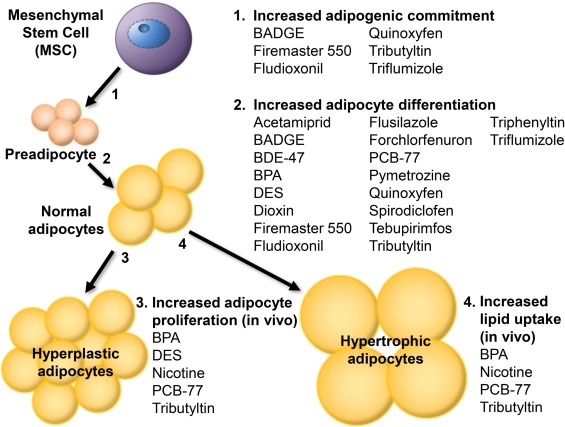
La secrezione di importanti molecole, come ad esempio la leptina, sono inficiate dagli MDCs. L’esposizione al BPA e ai PFOA, si è visto aumentare i livelli di leptina e diminuire quelli di adiponectina, inoltre il BPA aumenta i livelli di IL-6 (notoriamente pro-infiammatoria) e TNF.
Perciò l’alterazione nella secrezione di fondamentali molecole segnale, unitamente, come si è visto, all’aumento dei grassi circolanti, fanno sì che gli MDCs possano indurre infiammazione, NAFLD, dislipidemia, insulino-resistenza, e altre condizioni tipiche della sindrome metabolica.
Bibliografia:
- Heindel, J. J., Blumberg, B., Cave, M., Machtinger, R., Mantovani, A., Mendez, M. A., … & Vandenberg, L. N. (2017). Metabolism disrupting chemicals and metabolic disorders. Reproductive Toxicology, 68, 3-33.
- Sui, Y., Helsley, R. N., Park, S. H., Song, X., Liu, Z., & Zhou, C. (2015). Intestinal pregnane X receptor links xenobiotic exposure and hypercholesterolemia. Molecular Endocrinology, 29(5), 765-776.
- Farooqi, I. S., Keogh, J. M., Yeo, G. S., Lank, E. J., Cheetham, T., & O’rahilly, S. (2003). Clinical spectrum of obesity and mutations in the melanocortin 4 receptor gene. New England Journal of Medicine, 348(12), 1085-1095.
- Gao, B., Bian, X., Mahbub, R., & Lu, K. (2017). Sex-specific effects of organophosphate diazinon on the gut microbiome and its metabolic functions.Environmental health perspectives, 125(2), 198.
- Lee, H. M., He, Q., Englander, E. W., & Greeley Jr, G. H. (2000). Endocrine disruptive effects of polychlorinated aromatic hydrocarbons on intestinal cholecystokinin in rats. Endocrinology, 141(8), 2938-2944.
- Zhang, L., Nichols, R. G., Correll, J., Murray, I. A., Tanaka, N., Smith, P. B., … & Gonzalez, F. J. (2015). Persistent organic pollutants modify gut microbiota–host metabolic homeostasis in mice through aryl hydrocarbon receptor activation.Environmental health perspectives, 123(7), 679.
- Dheer, R., Patterson, J., Dudash, M., Stachler, E. N., Bibby, K. J., Stolz, D. B., … & Stolz, J. F. (2015). Arsenic induces structural and compositional colonic microbiome change and promotes host nitrogen and amino acid metabolism.Toxicology and applied pharmacology, 289(3), 397-408.
- Decherf, S., Seugnet, I., Fini, J. B., Clerget-Froidevaux, M. S., & Demeneix, B. A. (2010). Disruption of thyroid hormone-dependent hypothalamic set-points by environmental contaminants. Molecular and cellular endocrinology, 323(2), 172-182.
- Monje, L., Varayoud, J., Muñoz-de-Toro, M., Luque, E. H., & Ramos, J. G. (2010). Exposure of neonatal female rats to bisphenol A disrupts hypothalamic LHRH pre-mRNA processing and estrogen receptor alpha expression in nuclei controlling estrous cyclicity. Reproductive Toxicology, 30(4), 625-634.
- Riu, A., Grimaldi, M., le Maire, A., Bey, G., Phillips, K., Boulahtouf, A., … & Balaguer, P. (2011). Peroxisome proliferator-activated receptor γ is a target for halogenated analogs of bisphenol A. Environmental health perspectives,119(9), 1227.
- Apelberg, B. J., Witter, F. R., Herbstman, J. B., Calafat, A. M., Halden, R. U., Needham, L. L., & Goldman, L. R. (2007). Cord serum concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in relation to weight and size at birth. Environmental health perspectives, 115(11), 1670.
- Jiang, Y., Xia, W., Yang, J., Zhu, Y., Chang, H., Liu, J., … & Xu, S. (2015). BPA-induced DNA hypermethylation of the master mitochondrial gene PGC-1α contributes to cardiomyopathy in male rats. Toxicology, 329, 21-31.
- Choi, J. J., Eum, S. Y., Rampersaud, E., Daunert, S., Abreu, M. T., & Toborek, M. (2013). Exercise attenuates PCB-induced changes in the mouse gut microbiome. Environmental health perspectives, 121(6), 725.
- Nadal, A., Alonso-Magdalena, P., Soriano, S., Quesada, I., & Ropero, A. B. (2009). The pancreatic β-cell as a target of estrogens and xenoestrogens: Implications for blood glucose homeostasis and diabetes. Molecular and cellular endocrinology, 304(1), 63-68.
- Whitworth, K. W., Haug, L. S., Baird, D. D., Becher, G., Hoppin, J. A., Skjaerven, R., … & Cupul-Uicab, L. A. (2012). Perfluorinated compounds in relation to birth weight in the Norwegian Mother and Child Cohort Study.American journal of epidemiology, 175(12), 1209-1216.
- Ibrahim, M. M., Fjære, E., Lock, E. J., Naville, D., Amlund, H., Meugnier, E., … & Lund, S. (2011). Chronic consumption of farmed salmon containing persistent organic pollutants causes insulin resistance and obesity in mice. PloS one, 6(9), e25170.
- Wei, J., Lin, Y., Li, Y., Ying, C., Chen, J., Song, L., … & Xu, S. (2011). Perinatal exposure to bisphenol A at reference dose predisposes offspring to metabolic syndrome in adult rats on a high-fat diet. Endocrinology, 152(8), 3049-3061.
- Lee, D. H., Porta, M., Jacobs Jr, D. R., & Vandenberg, L. N. (2014). Chlorinated persistent organic pollutants, obesity, and type 2 diabetes. Endocrine reviews,35(4), 557-601.
- Cocco, S., Secondo, A., Del Viscovo, A., Procaccini, C., Formisano, L., Franco, C., … & Canzoniero, L. M. T. (2015). Polychlorinated biphenyls induce mitochondrial dysfunction in SH-SY5Y neuroblastoma cells. PloS one, 10(6), e0129481.
- Williams, A. A., Selvaraj, J., Srinivasan, C., Sathish, S., Rajesh, P., Balaji, V., … & Balasubramanian, K. (2013). Protective role of lycopene against Aroclor 1254-induced changes on GLUT4 in the skeletal muscles of adult male rat.Drug and chemical toxicology, 36(3), 320-328.
- Regnier, S. M., & Sargis, R. M. (2014). Adipocytes under assault: environmental disruption of adipose physiology. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 1842(3), 520-533.
- Shabalina, I. G., Kalinovich, A. V., Cannon, B., & Nedergaard, J. (2016). Metabolically inert perfluorinated fatty acids directly activate uncoupling protein 1 in brown-fat mitochondria. Archives of toxicology, 90(5), 1117-1128.
- Lee, J. H., Wada, T., Febbraio, M., He, J., Matsubara, T., Lee, M. J., … & Xie, W. (2010). A novel role for the dioxin receptor in fatty acid metabolism and hepatic steatosis. Gastroenterology, 139(2), 653-663.
- Alonso-Magdalena, P., Vieira, E., Soriano, S., Menes, L., Burks, D., Quesada, I., & Nadal, A. (2010). Bisphenol A exposure during pregnancy disrupts glucose homeostasis in mothers and adult male offspring. Environmental health perspectives, 118(9), 1243.