L’acetil-CoA è una molecola molto importante per il funzionamento della cellula, infatti ricopre un ruolo centrale nell’ambito del metabolismo energetico, ma le sue funzioni si estendono anche a mansioni di “regolazione”. Basti pensare che il pool cellulare di acetil-CoA, determinato anche dai corpi chetonici, è utilizzato come fonte di acetili per le reazioni di acetilazione degli istoni.
Il beta-idrossibutirrato agisce a livello epigenetico fondamentalmente attraverso due meccanismi: inibizione delle istone deacetilasi, attivazione delle istone acetiltransferasi. L’effetto netto è un aumento del livello di acetilazione degli istoni in determinate regioni, il che comporta ad esempio una maggiore produzione di BDNF (brain derived neurotrophic factor) e una più alta resistenza allo stress ossidativo. Ma il beta idrossibutirrato riesce ad agire in maniera diretta sui residui di lisina degli istoni, comportando un ulteriore livello di influenza da parte di tale corpo chetonico sull’espressione genetica.
Poiché la produzione di corpi chetonici riflette infine il livello di NAD+, allora si può concludere che essi riescano ad esplicare un ruolo di regolazione sulla attività delle sirtuine, fondamentalmente attraverso l’influenza esercitata sul pool cellulare di acetil-CoA e succinil-CoA.
Quindi tirando le somme, risulta evidente che i corpi chetonici, e in particolare il beta idrossibutirrato sono molecole in grado di avere anche funzione di segnalazione, nonché di agire a livello epigenetico. Di fondamentale importanza per la realizzazione di tali funzioni è sicuramente l’influenza che i corpi chetonici hanno nel determinare la concentrazione totale di acetil-CoA.
STRESS OSSIDATIVO E NEUROPROTEZIONE
Si definisce stress ossidativo una condizione determinata da una produzione di radicali liberi dell’ossigeno (ROS) superiore alle capacità dell’organismo di neutralizzare tali specie reattive. Molte osservazioni condotte sia in vitro che in vivo suggeriscono un ruolo importante dei corpi chetonici per quanto concerne la protezione verso questa tipologia di “stress”, in modo particolarmente importante a livello del sistema nervoso.
I corpi chetonici diminuiscono il grado di danno cellulare e diminuiscono il tasso di apoptosi sia nei neuroni che nelle cellule cardiache. Si pensa che ciò possa avvenire attraverso svariati meccanismi, non sempre, contrariamente a come si potrebbe pensare, direttamente proporzionali alla concentrazione dei corpi chetonici. Concentrazioni di poche millimoli di D-beta idrossi butirrato e di L-beta idrossi butirrato sono in grado di neutralizzare i radicali ossidrilici, mentre invece l’acetacetato neutrallzza numerose tipologie differenti di ROS. Il D-beta idrossi butirrato agisce positivamente anche a livello della catena di trasporto degli elettroni, e unitamente all’acetacetato è in grado di prevenire la deplezione di ATP nei neuroni, indotta dalla inibizione della glicolisi. Invece a livello dell’ippocampo solamente il D-beta idrossi butirrato è in grado di prevenire la perossidazione lipidica, in presenza di ipoglicemia.
In generale dai vari studi emerge come la dieta chetogenica e l’assunzione di esteri dei corpi chetonici, svolgano un ruolo neuroprotettivo in modelli si studio relativi allo stroke ischemico, alla malattia di Parkinson, all’epilessia, all’encefalopatia mitocondriale, all’acidosi lattica, alla malattia di Alzheimer. Va tuttavia riportato come talune osservazioni vadano in qualche modo controcorrente, nel senso che portano a risultati contraddittori, che suggeriscono l’inevitabile necessità di appronfondire la questione, attraverso studi ben congeniati e portati avanti con assoluto rigore e precisione.
Ad ogni modo considerando la “totalità” delle evidenze, si può concludere che il beta idrossi butirrato è correlato con una diminuzione dello stress ossidativo, poichè esso determina una inibizione nella produzione di ROS e di superossido, ma non solo, esso previene la perossidazione lipidica e l’ossidazione delle proteine, aumenta i livelli delle proteine antiossidanti e infine migliora i processi di produzione energetica a livello mitocondriale.
E’ tuttavia necessario condurre una importante riflessione: i benefici in termini di riduzione dello stress ossidativo, che si osservano nel corso di una dieta chetogenica, non possono essere totalmente attribuiti ai soli corpi chetonici; e il ruolo protettivo svolto dai corpi chetonici nei riguardi del sistema nervoso, non si può spiegare unicamente con una limitazione dello stress ossidativo.
NAFLD E METABOLISMO DEI CORPI CHETONICI
Con l’epidemia di obesità e sindrome metabolica che stiamo vivendo nei nostri tempi, si assiste ad uno spaventoso aumento tra la popolazione del cosiddetto fegato grasso non dovuto ad eccessiva assunzione di alcol. Questa condizione è sancita quando la concentrazione di trigliceridi intraepatici risulta superiore al 5% del peso del fegato intero. La steatosi epatica non alcolica è una condizione che se non affrontata è ingravescente, e determina dapprima una steatoepatite e infine la cirrosi che può evolvere e determinare l’insorgenza di un cancro in sede epatica.
L’accumulo eccessivo di lipidi nel fegato porta ad una relativa perdita di funzione dell’organo, contribuendo all’instaurarsi di condizioni come l’insulino-resistenza, nonchè può essere alla base dei processi patogenetici tipici delle malattie croniche cardiovascolari e renali. La patogenesi della steatosi epatica non alcolica (NAFLD) e della steatoeptatite non alcolica (NASH) non sono ancora ben precise, ma sicuramente è presente una alterazione nel metabolismo degli epatociti. Esiste un generale consenso nel descrivere una generale diminuzione delle capacità ossidative, specialmente mitocondriali, via via che si procede dalla NAFLD verso la NASH.
Ad ogni modo ciò che risulta abbastanza chiaro è che in caso di NALFD, o nel corso dell’evoluzione di tale condizione, la chetogenesi è alterata in senso negativo, ovvero si assiste ad una minore produzione di corpi chetonici. Ciò siginifica pertanto che l’acetil-CoA derivante dall’ossidazione degli acidi grassi (aumentata rispetto al normale) può essere liberamente diretto, attraverso il ciclo di Krebs, verso l’ossidazione completa, che risulta pertanto aumentata, unitamente dunque allo stress ossidativo, e alla produzione di glucosio per gluconeogenesi, indotta dal fosfoenolpiruvato. Inoltre l’acetil-CoA può uscire dai mitocondri sottoforma di citrato, e partecipare come substrato fondamente alla lipogenesi.
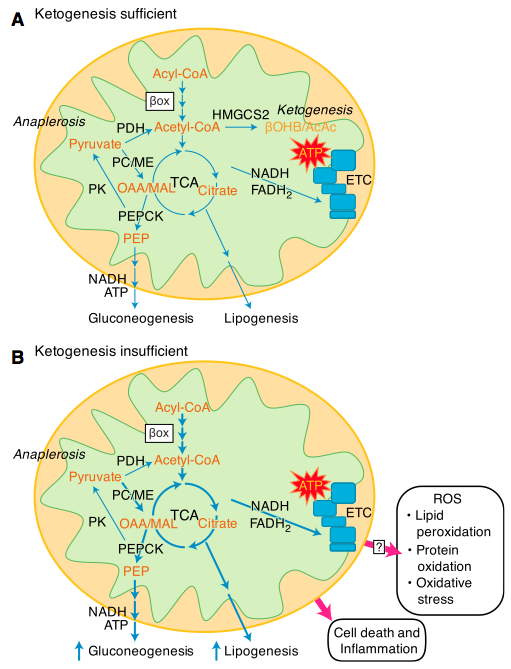
Quindi in sostanza ne risulta inficiata la produzione di corpi chetonici. Per comprendere se una alterata chetogenesi possa contribuire ad una alterazione nel metabolismo del glucosio, ed infine alla genesi stessa, o al peggioramento, della steatosi epatica non alcolica, alcuni ricercatori hanno condotto un interessante esperimento sui topi. In sostanza hanno “prodotto” topi con una pesante deficienza dell’enzima HMGCS2 e hanno somministrato a questi una dieta a basso contenuto di grassi e normale di carboidrati (quindi non chetogenica), e una dieta alta in grassi (quindi tendenzialmente chetogenica). I topi che avevano consumato la dieta low fat dimostravano una media iperglicemia, e si rinveniva la presenza di una ampia gamma di metaboliti che suggerivano l’attivazione dei processi di lipogenesi. I topi che avevano consumato la dieta ad alevato contenuto lipidico, ed avevano, come quelli di prima una pesante alterazione del processo chetogenetico (mancanza di HMGCS2), esibivano epatociti estremamente infiammati e danneggiati.
Questi rilsultati sono di supporto all’ipotesi che la chetogenesi non è un semplice “tampone” per l’acetil-CoA, ma bensì rappresenta un nodo di centrale importanza nell’omeostasi dell’epatocita, e che un aumento della chetogenesi vada per lo meno indagato con attenzione, in quanto potrebbe rivelarsi una potente arma per combattere le alterazioni metaboliche relative al glucosio, che si palesano nel corso di steatosi epatica e steatoepatite non alcoliche.
E’ chiaro che sono indispensabili ulteriori esperimenti per chiarire quali sono i meccanismi precisi attraverso cui una alterata chetogenesi epatica, contribuisca negativametne sul metabolismo del glucosio e sull’insorgenza e andamento della NASH e della NAFLD, tuttavia già ad oggi sono disponibili evidenze che suggeriscono chiaramente come una dieta chetogenica a basso contenuto di carboidrati abbia un impatto assolutamente positivo su queste condizioni patologiche.
Bibliografia
- Cahill Jr, George F. “Fuel metabolism in starvation.” Annu. Rev. Nutr. 26 (2006): 1-22.
-
D’Agostino, Dominic P., et al. “Therapeutic ketosis with ketone ester delays central nervous system oxygen toxicity seizures in rats.” American Journal of Physiology-Regulatory, Integrative and Comparative Physiology 304.10 (2013): R829-R836.
-
Frey, Samuel, et al. “The addition of ketone bodies alleviates mitochondrial dysfunction by restoring complex I assembly in a MELAS cellular model.” Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease 1863.1 (2017): 284-291.
-
Haces, María L., et al. “Antioxidant capacity contributes to protection of ketone bodies against oxidative damage induced during hypoglycemic conditions.” Experimental neurology 211.1 (2008): 85-96.
-
Murphy, Michael P. “How mitochondria produce reactive oxygen species.” Biochemical Journal 417.1 (2009): 1-13.
-
Perry, Rachel J., et al. “Propionate increases hepatic pyruvate cycling and anaplerosis and alters mitochondrial metabolism.” Journal of Biological Chemistry 291.23 (2016): 12161-12170.
-
Rahman, Mahbubur, et al. “The [beta]-hydroxybutyrate receptor HCA2 activates a neuroprotective subset of macrophages.” Nature communications 5 (2014): 3944.
-
Rinella, Mary E., and Arun J. Sanyal. “Management of NAFLD: a stage-based approach.” Nature reviews. Gastroenterology & hepatology 13.4 (2016): 196.
-
Shi, Xiaoxia, et al. “Acetoacetic acid induces oxidative stress to inhibit the assembly of very low density lipoprotein in bovine hepatocytes.” Journal of Dairy Research 83.4 (2016): 442-446.
-
Solinas, Giovanni, Jan Borén, and Abdul G. Dulloo. “De novo lipogenesis in metabolic homeostasis: More friend than foe?.” Molecular metabolism 4.5 (2015): 367-377.
-
Yin, Jun Xiang, et al. “Ketones block amyloid entry and improve cognition in an Alzheimer’s model.” Neurobiology of aging 39 (2016): 25-37.